
Exokrin pankreasinsufficiens (EPI) kännetecknas av brist på exokrina pankreasenzymer vilket leder till försämrad matsmältning (maldigestion). Det är välkänt att EPI förknippas med pankreassjukdomar som akut och kronisk pankreatit, cystisk fibros, pankreascancer osv. Förutom dessa tillstånd bör risken att utveckla EPI även vägas in vid sjukdomstillstånd utanför pankreas, såsom celiaki och inflammatorisk tarmsjukdom (inflammatory bowel disease, IBD).1–3
Celiaki, som även kallas glutenintolerans, är en delvis immunmedierad sjukdom som huvudsakligen påverkar tunntarmen. Morfologiskt karakteriseras celiaki av trubbiga, små tarmvilli, krypthyperplasi och lymfocytinfiltration. Följaktligen försämrar den tarmens absorptionsförmåga vilket leder till diarré, malabsorption och därav systemiska förändringar.2 Även om det är allmänt känt att celiaki kan förekomma utan gastrointestinala symtom förblir diarré det typiska symtomet. Celiaki är associerat med EPI. Även om celiaki tillsammans med svår EPI verkar vara sällsynt så är mild till måttlig EPI ofta ett fynd vid obehandlad celiaki.2,4
Rapporter tyder på förekomst av EPI hos patienter med IBD. Inflammatorisk tarmsjukdom – inklusive Crohns sjukdom och ulcerös kolit – kännetecknas av kronisk recidiverande tarminflammation som ett resultat av en patologisk, kontinuerlig immunreaktion mot mikrober i tarmen, medierad av individens genetiska känslighet.5,6
Den sammanslagna globala seroprevalensen och biopsibekräftade prevalensen av celiakier är 1,4% respektive 0,7%. Den högsta prevalensen rapporteras i Europa (0,8%) och Oceanien (0,8%), medan den lägsta prevalensen rapporteras i Sydamerika (0,4%).7
Exokrin pankreasinsufficiens förknippas med celiaki och är en etablerad orsak till kronisk diarré. Studier har rapporterat lågt fekalt elastas-1 hos 15–30 % av celiakipatienterna med pågående eller ihållande diarréer.4,6
Epidemiologin för EPI hos patienter med inflammatorisk tarmsjukdom är inte helt klarlagd. Den rapporterade prevalensen av detta tillstånd varierar avsevärt beroende på patienturval och de diagnostiska tester som används. En prospektiv studie uppskattade en prevalens på 14–22 % av EPI hos patienter med inflammatorisk tarmsjukdom med hjälp av fekalt elastas-1-test, medan en annan studie som använde sig av sekretin-cerulein-test fann att lipas var minskat hos 58–80 % av patienterna med inflammatorisk tarmsjukdom (Figur 1). Risken för att utveckla EPI rapporteras som högre hos patienter med inflammatorisk tarmsjukdom med lös avföring, ett stort antal tarmtömningar per dag och tidigare kirurgi.5,6
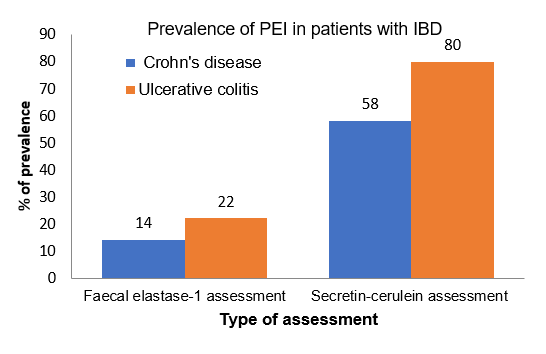
Figur 1: Prevalens av EPI hos patienter med inflammatorisk tarmsjukdom, genom utvärdering.6
Celiaki är resultatet av en interaktion mellan genetiska faktorer (förekomst av HLADQ2/DQ8-serotyp), miljöfaktorer (glutenkonsumtion) och immunologiska faktorer (strukturell skada på tarmslemhinnan).2 Exokrin pankreasinsufficiens hos patienter med celiaki beror sannolikt på flera faktorer. Möjliga mekanismer för celiaki-medierad EPI listas nedan4:
- Felaktig reglering av pankreasfunktionen som en onormal respons på intraluminalt innehåll
- Nedsatt frisättning av kolecystokinin vilket leder till asynkroni mellan ventrikeltömning, frigörande av pankreasenzymer och kontraktion av gallblåsan
- Högre nivåer av plasmapeptid YY – en hormonpeptid med uttalad hämmande effekt på magsyrainsöndring, mag-tarmmotilitet och produktionen av pankreasenzym
De ovan listade avvikelserna tillsammans med atroferade tarmvilli kan leda till minskade mängder pankreasenzym och påföljande steatorré.4
Etiologin för inflammatorisk tarmsjukdom är inte fullständigt klarlagd. Forskning antyder att en individs genetiska känslighet, den externa miljön, mikrobiella tarmflora och immunrespons spelar roll för patogenesen för inflammatorisk tarmsjukdom.8
Exokrin pankreasinsufficiens orsakar ett kluster av symtom som varierar beroende på svårighetsgrad och omfattar2:
- Steatorré (illaluktande, fettrik avföring)
- Buksmärta
- Flatulens
- Viktminskning
- Undernäring
Symtomen på EPI liknar ofta de som förekommer vid andra mag-tarmsjukdomar vilket kan leda till att det tar lång tid innan tillståndet upptäcks. Dessutom kanske steatorrén, det klassiska kardinalsymtomet på EPI, inte visar sig förrän sjukdomen är långt framskriden.
Exokrin pankreasinsufficiens förknippas också med brist på fettlösliga vitaminer (vitamin A, D, E och K), magnesium, kalcium och essentiella fettsyror och aminosyror.10
Försämrad matsmältning (maldigestion) och malabsorption (försämrat upptag) av näringsämnen på grund av EPI kan ha progressiva och skadliga effekter på patienternas välbefinnande och livskvalitet. Detta kan även ha en negativ inverkan på den bakomliggande sjukdomens progress och öka morbiditet och mortalitet.11–13 För mer information om komplikationer till EPI kan du läsa artikeln om ”komplikationer på grund av EPI”.
Det finns flera diagnostiska metoder tillgängliga för diagnostisering av EPI. Översiktligt så kan dessa tester kategoriseras i två olika typer: direkta och indirekta.
Indirekta tester utvärderar konsekvensen av EPI – genom att undersöka fettinnehåll i avföring, nivåer av fekalt elastas-1 eller onormala resultat på pankreolauryltestet. Dessa tester har en tendens att vara billigare och enklare att utföra jämfört med direkta tester av pankreasfunktionen.
Direkta tester utvärderar istället pankreas sekretoriska kapacitet direkt. Även om de är känsliga så föredras de inte i klinisk vardag då de är invasiva, tidsödande och dyra. Dessutom är de inte användbara vid monitorering av responsen på pankreasenzymersättningsterapi (Pancreatic Enzyme Replacement Therapy, PERT). Vidare är dessa tester inte standardiserade på grund av bristande konsensus rörande protokoll och omfattande variation i resultaten.3
Det är värt att nämna att eftersom patienter med celiaki ofta har diarré (som inte är relaterad till EPI) och som kan sänka koncentrationen av fekalt elastas-1, kan ett falskt positivt resultat erhållas vid ett fekalt elastas-1-test.4, Dessutom kan pankreasengagemanget hos patienter med inflammatorisk tarmsjukdom komplicera förloppet av inflammatorisk tarmsjukdom. De kliniska symtomen på inflammatorisk tarmsjukdom kan överlappa andra sjukdomar som har sitt ursprung i pankreas. Därför är diagnosen av pankreassjukdomar vid inflammatorisk tarmsjukdom svår att ställa. Av dessa skäl bör patienter med inflammatorisk tarmsjukdom med symtom på pankreassjukdom utredas noga för att utesluta samtidig förekomst av pankreassjukdom.5
Precis som vid EPI på grund av andra orsaker är PERT hörnpelaren i behandlingen av EPI orsakad av celiaki och inflammatorisk tarmsjukdom. Den kompenserar för bristande endogen enzymsekretion. Eftersom graden av EPI varierar mellan patienter ska dosen av pankreasenzymer titreras baserat på individens behov. Behandling med PERT har positiv effekt på symtomen hos patienter med EPI och samtidig celiaki och inflammatorisk tarmsjukdom.2,4,6,9
Matsmältningsenzymer kan, förutom att användas för behandling av EPI, hjälpa till i den enzymatiska nedbrytningen av gluten, som annars metaboliseras dåligt och kan utlösa underliggande immunsvar, vilket leder till celiaki.2
En longitudinell prospektiv studie utvärderade PERT och fann att PERT kan ha en positiv effekt på symtomen hos celiakipatienter med diarré och lågt fekalt elastas-1. Longitudinella data antydde också att PERT skulle kunna sättas ut hos en betydande andel av patienterna allt eftersom symtomen förbättras (Figur 2).4
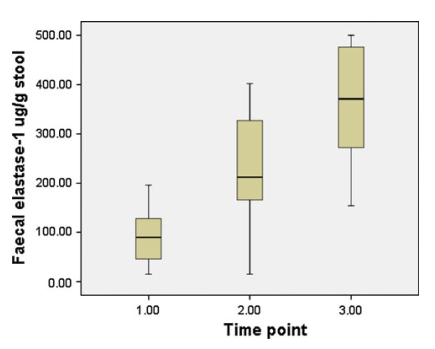
Figur 2: Medianvärde på fekalt elastas-1 vid punkt 0, efter sex månader och vid uppföljning.4
Saker att komma ihåg2–4,6:
- Exokrin pankreasinsufficiens är ett viktigt och ofta odiagnostiserat kliniskt tillstånd med potentiellt negativa effekter på näringsstatus hos patienter med sjukdomar i och utanför pankreas.
- Diagnos på EPI i ett tidigare skede kan underlätta initieringen av PERT innan betydande komplikationer uppstår.
- Behandling med pankreasenzymersättningsterapi kan ha positiva effekter på symtom hos patienter med celiaki och inflammatorisk tarmsjukdom med diarré och lågt fekalt elastas-1.
Medicinskt granskad av Viatris staff
- 02 Feb 2021
-
References
- Domínguez-Muñoz JE. Pancreatic enzyme replacement therapy: Exocrine pancreatic insufficiency after gastrointestinal surgery. HPB (Oxford). 2009;11(3):3–6.
- Australasian guidelines for the management of pancreatic exocrine insufficiency. 2015. Available at: http://pancreas.org.au/wp-content/uploads/2016/01/APC-GUIDELINES-2015.pdf. Accessed on: 2 April 2019.
- Capurso G, Traini M, PiciucchiM, et al. Exocrine pancreatic insufficiency: Prevalence, diagnosis, and management. Clin Exp Gastroenterol. 2019;12:129–139.
- Evans KE, Leeds JS, Morley S, et al. Pancreatic insufficiency in adult celiac disease: Do patients require long-term enzyme supplementation? Dig Dis Sci.2010;55:2999–3004.
- Fousekisa FS, Theopistosa VI, Katsanos KH, et al. Pancreatic involvement in inflammatory bowel disease: A review. J Clin Med Res. 2018;10(10):743–751.
- Maconi G, Dominici R, Molteni M, et al. Prevalence of pancreatic insufficiency in inflammatory bowel diseases: Assessment by fecal elastase-1. Dig Dis Sci. 2008;53(1):262–270.
- Singh P, Arora A, Strand TA, et al. Global prevalence of celiac disease: Systematic review and meta-analysis. Clin Gastroenterol Hepatol. 2018;16:823–836.
- Zhang Y, Li Y. Inflammatory bowel disease: Pathogenesis. World J Gastroenterol. 2014;20(1):91–99.
- Leeds JS, Hopper AD, Hurlstone DP, et al. Is exocrine pancreatic insufficiency in adult coeliac disease a cause of persisting symptoms? Aliment PharmacolTher. 2007;25:265–271.
- Lohr JM, Dominguez-Munoz E, Rosendahl E, et al. United European Gastroenterology evidence-based guidelines for the diagnosis and therapy of chronic pancreatitis (HaPanEU). United European Gastroenterology Journal. 2017;5(2):153–199.
- Tignor AS, Wu BU, Whitlock TL, et al. High prevalence of low-trauma fracture in chronic pancreatitis. Am J Gastroenterol. 2010;105(12):2680–2686.
- Shintakuya R, Uemura K, Murakami Y, et al. Sarcopenia is closely associated with pancreatic exocrine insufficiency in patients with pancreatic disease. Pancreatology. 2017;17(1):70–75.
- de la Iglesia-Garcia, Vallejo-Senra N, Lopez-Lopez A, et al. Effect of pancreatic exocrine and endocrine insufficiency in cardiovascular events in patients with chronic pancreatitis (CP). A prospective cohort study. Pancreatology. 2018;(18):1–188.
 Foto: iStock by Getty Images
Foto: iStock by Getty Images
Diagnostisering av patienter med exokrin pankreasinsufficiens
Alla patienter med oavsiktlig viktnedgång, buksmärta, näringsbrist och diarré bör utredas för exokrin pankreasinsufficiens (EPI). Att ställa diagnosen EPI kan ske med invasiva och icke-invasiva tester.
 Foto: Shutterstock
Foto: Shutterstock
Behandling
Pankreasenzymersättningsterapi (pancreatic enzyme replacement therapy, PERT) är standardbehandlingen vid exokrin pankreasinsufficiens (EPI). Dessutom kan livsstilsförändringar och vitamintillskott krävas för att behandla EPI.



